อินดิเคเตอร์
อินดิเคเตอร์ คือ สารที่ใช้บอกความเป็นกรด-เบส ของสารละลายได้อย่างหนึ่ง
ปฏิกิริยาระหว่างกรดกับเบส
เรียกว่า ปฏิกิริยาสะเทิน ปฏิกิริยาระหว่างกรดกับเบส จะได้เกลือกับน้ำ
ปฏิกิริยาระหว่างกรดกับเบส สามารถแบ่งได้ดังนี้
1.ปฏิกิริยาระหว่างกรดแก่กับเบสแก่
HCl (aq) + KOH (aq)  KCl (aq) + H2O (l)
KCl (aq) + H2O (l)
2.ปฏิกิริยาระหว่างกรดแก่กับเบสอ่อน
HCl (aq) + NH4OH (aq)  NH4Cl (aq) + H2O (l)
NH4Cl (aq) + H2O (l)
3.ปฏิกิริยาระหว่างกรดอ่อนกับเบสแก่
CH3COOH (aq) + NaOH (aq)  CH3COONa (aq) + H2O (l)
CH3COONa (aq) + H2O (l)
4.ปฏิกิริยาระหว่างกรดอ่อนกับเบสอ่อน
HCN (aq) + NH4OH (aq)  NH4CN (aq) + H2O (l)
NH4CN (aq) + H2O (l)
เกลือ
เกลือเป็นสารประกอบไอออนิก ประกอบด้วยไอออนบวกและไอออนลบ
กรด + เบส
เช่น HCl (aq) + NaOH (aq)
H2SO4 (aq) + Ba(OH)2 (aq)
3.ปฏิกิริยาไฮโดรไลซีส
ไฮโดรไลซีส หมายถึง ปฏิกิริยาระหว่างเกลือกับน้ำ เมื่อเกลือละลายในน้ำ เกลือจะแตกตัวออกเป็นไอออนบวกและไอออนลบทั้งหมด
การไทเทรตกรด-เบส (Acid-base titration)
จุดสมมูล
คือจุดที่กรดและเบสทำปฏิกิริยาพอดีกัน
จุดยุติ
จุดยุติ
คือจุดที่อินดิเคเตอร์เปลี่ยนสี ขณะไทเทรตกรด-เบสอยู่ ในทางปฏิบัติถือว่าจุดยุติ เป็นจุดเดียวกับจุดสมมูล


คลิปการไทเทรต
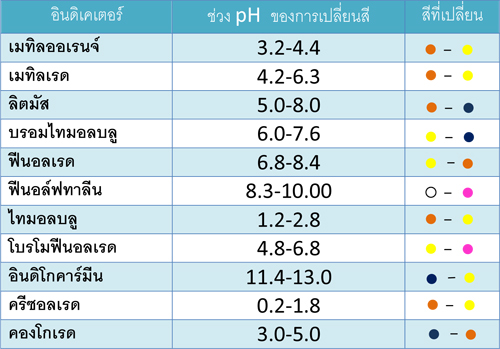
ตารางแสดงอินดิเคเตอร์
สารละลายบัฟเฟอร์ (Buffer Solution)
ตัวอย่าง
1. จงคำนวณหา pH ของสารละลาย 1.00M CH3COOH และ
1.00M CH3COONa(Ka ของ CH3COOH=1.8x10-5 ที่ 25 0C)
วิธีทำ CH3COONa(s)— CH3COO - (aq) + Na +(aq)
CH3COOH + H2O= CH3COO - + H3O +
ความเข้มข้นเริ่มต้น 1.00 1.00 -
ขณะเปลี่ยนแปลง -x +x +x
ที่สมดุล 1.00-x 1.00+x +x
Ka =[ CH3COO - ][ H3O+]/[ CH3COOH ]
1.8x10-5 = x(1.00)/1.00
x =[ H3O+] =1.8x10-5
pH =-log[ H3O+]
=-log(1.8x10-5) = 4.74
1. จงคำนวณหา pH ของสารละลาย 1.00M CH3COOH และ
1.00M CH3COONa(Ka ของ CH3COOH=1.8x10-5 ที่ 25 0C)
วิธีทำ CH3COONa(s)— CH3COO - (aq) + Na +(aq)
CH3COOH + H2O= CH3COO - + H3O +
ความเข้มข้นเริ่มต้น 1.00 1.00 -
ขณะเปลี่ยนแปลง -x +x +x
ที่สมดุล 1.00-x 1.00+x +x
Ka =[ CH3COO - ][ H3O+]/[ CH3COOH ]
1.8x10-5 = x(1.00)/1.00
x =[ H3O+] =1.8x10-5
pH =-log[ H3O+]
=-log(1.8x10-5) = 4.74

